分类: 器械
2022-07-26
7月20日,国家药监局网站发布关于对四川拜阿蒙生物活性材料有限责任公司飞行检查情况的通告。全文如下。
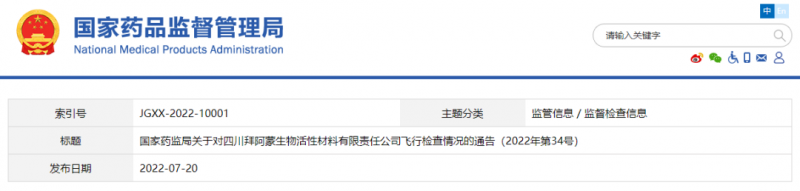
国家药监局关于对四川拜阿蒙生物活性材料有限责任公司飞行检查情况的通告
(2022年第34号)
近期,国家药品监督管理局组织检查组对四川拜阿蒙生物活性材料有限责任公司进行了飞行检查。检查发现该企业质量管理体系主要存在以下缺陷:
一、机构与人员、厂房与设施和设备方面
企业有位于成都市望江路的生产场地A区和位于成都市高新区西芯大道的生产场地B区。现场检查发现,B区的生产场地、机构和人员、生产和检验设备属于另一关联公司。B区生产现场的设备操作规程、作业指导书等文件均为关联公司制定,企业在A区、B区的程序文件、制度文件存在两个不同版本;企业B区微生物室使用普通空调接高效过滤器的方式对空气进行净化,使用小型可移动式臭氧发生器进行室内环境消毒。以上不符合《医疗器械生产质量管理规范》和《医疗器械生产质量管理规范附录植入性医疗器械》(以下简称《规范》)中下列要求:一是企业应当配备与生产产品相适应的专业技术人员、管理人员和操作人员,具有相应的质量检验机构或者专职检验人员;二是企业应当配备与产品生产规模、品种、检验要求相适应的检验场所和设施;三是企业应当配备与所生产产品和规模相匹配的生产设备、工艺装备等,并确保有效运行。
二、采购管理方面
企业未与B类、C类物料供应商签订质量协议,采购控制程序未对不同类别物资是否签订质量协议予以明确,不符合《规范》中企业应当与主要原材料供应商签订质量协议,明确双方所承担的质量责任的要求。
三、生产管理方面
企业未能提供灭菌确认报告,不符合《规范》中灭菌过程应当按照相关标准要求在初次实施前进行确认,必要时再确认,并保持灭菌过程确认记录的要求。
该企业质量管理体系存在严重缺陷,不符合《医疗器械生产质量管理规范》《医疗器械生产质量管理规范附录植入性医疗器械》相关规定。该企业已对其质量管理体系存在的上述缺陷予以确认。
四川省药品监督管理局应当按照《医疗器械监督管理条例》第七十二条规定,对企业依法采取暂停生产的控制措施,对涉及违反《医疗器械监督管理条例》及相关规定的,应当依法处理;并责令该企业评估产品安全风险,对有可能导致安全隐患的,按照《医疗器械召回管理办法》的规定召回相关产品。
该企业完成全部项目整改并经四川省药品监督管理局复查合格后方可恢复生产。
特此通告。
国家药监局
2022年7月18日
资讯来源:长江云
责任编辑:百合
声明:该文观点仅代表作者本人,如有侵权请联系作者删除,也可通过邮件或页面下方联系我们说明情况,内容由发布者注册发布,本网系信息发布平台,仅提供信息存储空间服务,任何单位、个人、组织不得利用平台发布任何不实信息,一切法律后果都由发布者自行承担。T[telephone]}
相关阅读
相关推荐
精彩图文

宁夏红寺堡区弘德村:黄河水甜在心头 好日子还在后头

习近平出席第二十五届圣彼得堡国际经济论坛全会并致辞
金砖国家领导人第十四次会晤举行 习近平主持会晤并发表重要讲话

花游综述:中国队获4金2铜连创历史 部分项目人才空白仍需解决

珍宝海鲜舫沉没引关注,有香港海事专家质疑拖船方式不合理

珠江流域北江预计将发生特大洪水,广东启动防汛Ⅰ级响应!直击多地救灾现场
新闻排行
相关推荐
精彩图文

宁夏红寺堡区弘德村:黄河水甜在心头 好日子还在后头

习近平出席第二十五届圣彼得堡国际经济论坛全会并致辞
金砖国家领导人第十四次会晤举行 习近平主持会晤并发表重要讲话

花游综述:中国队获4金2铜连创历史 部分项目人才空白仍需解决

珍宝海鲜舫沉没引关注,有香港海事专家质疑拖船方式不合理

珠江流域北江预计将发生特大洪水,广东启动防汛Ⅰ级响应!直击多地救灾现场
新闻排行